AAVベクターシステム、AAV製造、トランスダクションおよびAAV遺伝子治療
アデノ随伴ウイルス (AAVベクター) -概要
以下にアデノ随伴ウイルス (AAV) ベクターシステム、AAV製造、AAVトランスダクション、およびAAV遺伝子治療のランドスケープ、プロトコル、ガイドラインについて説明します。AAVベクタープラスミドのクローニング、AAVパッケージング、精製、AAVカプシドの進化、およびAAV遺伝子治療の洞察について詳述しています。
アデノ随伴ウイルス (AAVベクター) -目次
- 1. アデノ随伴ウイルス (AAV) ベクターとは?
- 2. AAV遺伝子治療のレビュー
- 3. AAVベクターを介した遺伝子導入の利点と欠点
- 4. AAVゲノム構造(ITR、Rep、Cap、VP1、VP2、VP3)とAAVウイルスの組み立て
- 5. AAVウイルスのライフサイクル - 感染から再生まで
- 6. AAV血清型とAAV組織特異的トロピズム
- 7. AAVベクターシステム (AAVベクターシステム)
- 8. AAVエンジニアリング (AAVカプシドの進化)
- 9. AAVベクタートランスダクション - AAVベクター遺伝子導入 in vivo
- 10. アデノ随伴ウイルス (AAVベクター) - 製造プロトコル、ガイドライン、および参考文献
アデノ随伴ウイルス (AAVベクター) とAAV遺伝子治療 - 知識ベース
1. アデノ随伴ウイルス (AAV) ベクターとは?
アデノ随伴ウイルス (AAV) は、1960年代にピッツバーグ大学のボブ・アチソンとNIHのウォレス・ロウによってアデノウイルスの準備における汚染物として初めて記載されたヒトパルボウイルスの小型一本鎖DNAウイルスです [1,2]。発見後まもなく、AAVは人間から分離されましたが、血清学的研究により、AAV自体はアデノウイルスやヘルペスウイルスなどの補助ウイルスに感染した人々に存在していても、病気を引き起こさないことが示唆されました [3]。組換えAAVベクター (rAAV) の開発により、AAVの複製に必要なアデノウイルス補助遺伝子が同定され、AAV製造のためのプラスミドにクローン化され、補助ウイルスの必要性が解消されました。現在、AAV製造はAAV-293細胞での3プラスミド共トランスフェクションシステム (遺伝子興味のあるAAVプラスミド、AAVパッケージングプラスミドAAV-RC (AAV複製とAAVカプシド) およびpHelper (AAVヘルパープラスミド)) を採用しており、AAVの精製プロセスを大幅に簡素化しています。
2. AAV遺伝子治療のレビュー
AAVは最も優れた遺伝子治療ベクターであることが証明されています。現在までに、AAVベクターを用いた遺伝子導入のために204件以上の臨床試験が実施されており [4]、多くの病気に対して有望な遺伝子治療の成果がPhase 1、Phase 2、Phase 3の試験で得られています(表1)、リポタンパクリパーゼ欠乏症 (LPLD) [5]、脊髄性筋萎縮症 (SMA) [6]、網膜ジストロフィー [7,8]、嚢胞性線維症 [9,10]、デュシェンヌ型筋ジストロフィー [11]、血友病 [12]、うっ血性心不全 [13]、パーキンソン病 [14]、およびリウマチ性関節炎 [15,16] などがあります。その中でも、スパーク社のLuxturnaは網膜ジストロフィー患者の治療にFDAから承認され、AveXis社のAVXS-101は脊髄性筋萎縮症の患者に優れた治療効果を示しており、マイクロジストロフィンおよび凝固因子IXを用いたAAVはデュシェンヌ型筋ジストロフィーおよび血友病の治療に大きな可能性を示しています。
a)網膜ジストロフィー治療のためのLuxturna
FDAは、LCA (レーバー先天性黒内障) 患者の網膜ジストロフィー治療のために設計された一回限りの遺伝子治療製品であるLUXTURNA™ (voretigene neparvovec-rzyl) を2017年12月に承認しました。LUXTURNAは、米国で初めて遺伝性網膜疾患 (IRD) に対する薬理学的治療法として承認されたものであり、遺伝性疾患に対する初のAAVベクター遺伝子治療です。LUXTURNAはAAV2を使用してRPE65遺伝子の機能的なコピーを網膜色素上皮 (RPE) 細胞に導入し、RPE65変異を補います [17]。機能的なRPE65遺伝子が導入されることで、網膜色素上皮細胞はRPE65タンパク質を生成し始め [18]、視覚サイクルを回復させるために11-cisレチナール (重要な視覚色素成分) が再生されます [4,19]。現在までに、Phase 1試験ではRPE65媒介遺伝性網膜ジストロフィーにおける遺伝子置換の潜在的な利益が示されており、Phase 3試験でも遺伝性網膜ジストロフィー参加者におけるLuxturna遺伝子治療の有効性と安全性が示されています [20]。
| Indication | Gene | AAV serotype | Route of AAV delivery | Phase | Sponsor |
| Lipoprotein lipase deficiency | LPL | AAV1 | Intramuscular | II–Ⅲ | Amsterdam Molecular Therapeutics |
| LPL | AAV1 | Intramuscular | Ⅰ | UniQure Biopharma B.V. | |
| Spinal muscular atrophy 1 | SMN | AAV9 | Intravenous | Ⅰ | AveXis |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| Spinal muscular atrophy | SMN | AAV9 | Intravenous | Ⅰ | AveXis |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| Retinal dystrophy | RPE65 | AAV2 | Subretinal | Ⅰ–Ⅱ | University College, London |
| PDE6B | AAV5 | Subretinal | Ⅰ–Ⅱ | Horama S.A | |
| Cystic fibrosis | CFTR | AAV5 | Lung, via aerosol | Ⅰ | NIDDK |
| Hemophilia A | HLP-FVIII-V3 | AAV8 | Intravenous | Ⅰ | University College, London |
| Hemophilia B | FIX | AAV2 | Intravenous | Ⅰ | Spark Therapeutics |
| FIX16 | AAVrh10 | Intravenous | Ⅰ–Ⅱ | Ultragenyx Pharmaceutical Inc | |
| Arthritis | TNFR:Fc | AAV2 | Intraarticular | Ⅰ | Targeted Genetics Corporation |
| TNFR:Fc | AAV2 | Intraarticular | Ⅰ–Ⅱ | Targeted Genetics Corporation | |
| hIFN-b | AAV5 | Intraarticular | Ⅰ | Arthrogen | |
| hIFN-b | AAV5 | Intraarticular | Ⅰ | Arthrogen | |
| Congestive heart failure | SERCA2a | AAV1 | Intracoronary | Ⅰ–Ⅱ | Celladon Corporation |
| SERCA2a | AAV1 | Intracoronary | Ⅱ | Celladon Corporation | |
| SERCA2a | AAV1 | Intracoronary | Ⅱ | Imperial College London | |
| SERCA2a | AAV1 | Intracoronary | Ⅱ | Assistance Publique - Hôpitaux de Paris | |
| SERCA2a | AAV1 | Intracoronary | Ⅰ–Ⅱ | Celladon Corporation | |
| Parkinson's disease | GAD | AAV2 | Surgical infusion | Ⅰ | Neurologix, Inc. |
| GAD | AAV2 | Intrastriatal | Ⅰ | Genzyme, a Sanofi Company | |
| NTN | AAV2 | Intrastriatal | Ⅰ | Genzyme | |
| NTN | AAV2 | Bilateral Intraputaminal (IPu) | Ⅱ | Genzyme | |
| NTN | AAV2 | Bilateral Intraputaminal and Intranigral | Ⅰ–Ⅱ | Sangamo Therapeutics | |
| Alzheimer's disease | NGF | AAV5 | Bilateral, stereotactic | Ⅰ | Ceregene |
| APOE2 | AAVrh.10 | Intracisternal | Ⅰ | Weill Medical College of Cornell University |
b)脊髄性筋萎縮症(SMA)の治療に使用されるAVXS-101
AVXS-101は、AveXis(現在はノバルティスが所有)によって開発されており、AAV9ベクターを使用してSMA患者の運動ニューロン細胞にSMN1遺伝子の機能的コピーを導入することを目的としています[21]。AVXS-101のSMN1トランスジーンは二重鎖DNAであり、遺伝子の指示を含み、自然遺伝子と同じ形態を持つため、持続的なSMNタンパク質を迅速に生成し、より効率的な体内での遺伝子治療が可能です。SMA 1型患者全員において、AVXS-101の安全性、忍容性、および運動機能の著しい改善がフェーズ1臨床試験で確認されました[51]。初期の主要な結果に基づき、FDAはすべてのタイプのSMA治療に対するAVXS-101にオーファンドラッグ指定を、またSMA 1型治療に対する画期的治療指定およびファストトラック指定を付与しました。同様に、欧州医薬品庁(EMA)も2017年1月にSMA 1型治療に対するAVXS-101にPRIME(PRIority Medicines)プログラムへのアクセスを許可しました。さらに、2017年12月には、AveXisはSMA II型患者の2つの異なる年齢層でAVXS-101遺伝子治療の安全性、最適投与量、および効果の概念実証を評価するためのオープンラベル、多施設フェーズ1試験(STRONG)の開始を発表しました。現在、AveXisはSMA 1型乳児を対象としたフェーズ3試験(NCT03306277)を実施しており、AVXS-101遺伝子治療の安全性とSMA患者に対する効果をさらに理解し、他の運動ニューロン疾患を持つ小児および成人患者に新たな希望をもたらす可能性があります。
c)デュシェンヌ型筋ジストロフィー治療のためのマイクロジストロフィンを持つAAV
デュシェンヌ型筋ジストロフィー(DMD)はジストロフィン遺伝子の突然変異により引き起こされる重篤な遺伝性疾患であり、少年および若年男性において全身の筋肉の退行と壊死を引き起こします[22]。遺伝子治療の理論によれば、変異したジストロフィン遺伝子を機能的な遺伝子に置き換えることによりこの疾患を治癒することができます[23]。しかし、ジストロフィンcDNAの巨大なサイズと全身の筋肉の分布は、この困難な課題に対する大きな障害となっています。これらの障害に対処するため、研究者は大幅に短縮されたマイクロジストロフィン遺伝子を開発し、AAV2.5を使用した全身遺伝子導入を設計しました。AAV2.5は翻訳的に最適化されたAAVバリアントであり、AAV2よりも骨格筋での遺伝子導入が強く、AAV2中和抗体に対する交差反応性が低いことが示されています[11]。現在までに、プレクリニカルデータは、血管内AAVマイクロジストロフィン導入がマウスや犬などの動物において筋病理を著しく改善し、筋力を強化し、ジストロフィン性心筋症を軽減することを示唆しています[24,25]。DMD患者に対するAAV2.5のフェーズ1臨床試験は、合理的に設計されたAAVベクター(AAV2.5)が安全であり、忍容性が良好であることを示しており、臨床目標に最も適したAAVベクターのカスタマイズの基盤を築いています[11]。一方、AAV2.5を使用したマイクロジストロフィン遺伝子の臨床効果を評価するためにはさらなる臨床試験が必要であり、合成マイクロジストロフィンAAVベクターを使用した全身DMD治療の大きな展望を示しています[26]。
d)血友病B治療のための凝固因子IXを持つAAV
血友病B(HB)は、機能的な凝固因子IXタンパク質(FIX)の欠乏に起因するX連鎖疾患です[27]。現在のところ、プレクリニカルデータは、スケレタルマッスルまたは肝臓への凝固因子IXのAAVベクターメディエーション遺伝子転送が、マウスおよび犬において血友病Bの持続的な矯正を示していることを示唆しています[28,29]。FIX cDNA遺伝子導入によるAAVベクターを用いた血友病B治療の初期のフェーズI/II臨床試験の2つは、重大な副作用を示さなかったが、治療レベルのFIXを示さなかった筋肉試験とは対照的に、血友病犬の治療効果に近い治療効果を示しました[30]。現在までに、最適化された凝固因子IXコンストラクトを含むAAVベクターの全身投与による血友病Bの遺伝子治療は、数多くの患者の出血表現型を改善するなど、かなりの進展を遂げています[31]。しかし、患者における持続的な遺伝子治療には課題が残っており、AAVベクター、トランスジーンカセット、および矯正戦略の最適化を通じてFIXの長期発現を改善するための努力が必要です。
3. AAVベクターメディエーション遺伝子導入の利点と欠点
a) AAVメディエーション遺伝子導入の利点
AAVは遺伝子治療およびアイソジェニックヒト疾患モデルの作成のためのウイルスベクターを作成するための非常に魅力的な候補となっています。 1) 優れたバイオセーフティ評価。野生型AAVは現在までに体内で疾患を引き起こすことは知られておらず、AAVゲノム要素の大部分を削除した後、体内での再組換えAAV遺伝子導入のさらなる安全性が確保されています。 2) 低免疫原性。AAVは体内で非常に軽度の免疫反応を引き起こし、遺伝子導入中の明らかな病原性の欠如をさらにサポートします。 3) 広範な感染範囲。AAVは体内で分裂中および静止中の両方の細胞に感染することができ、多様な細胞タイプに遺伝子を導入することができます。 4) 安定した発現。長期の体内での遺伝子導入はAAVによって媒介されることができます。
b) AAVメディエーション遺伝子導入の欠点
アデノウイルスは多くの疾患治療に大きな利益をもたらしますが、いくつかの欠点もあります。
1) 最大の欠点は、ベクターのクローン作成容量が制限されていること(4.7kb未満)であり、大きな遺伝子の遺伝子導入においてその使用が制限されることです。(表3)[32]。 2) 非ヒト霊長類(NHP)およびヒトにおけるAAVに対する中和抗体の生成は、AAVメディエーション遺伝子治療の効果を低減させる可能性があります[33]。
| Comparison | Retrovirus | Lentivirus | Adenovirus | AAV |
| Genome | ss RNA | ss RNA | ds DNA | ss DNA |
| Integration | Yes | Yes | No | No |
| Packaging Capacity | 3kb | 4kb | 5.5kb | 2kb |
| Time to peak expression | 72h | 72h | 36h-72h | Cell: 7 days; Animals: 2 weeks |
| Sustainable time | About 3 weeks | Stable expression | Transient expression | > 6 months |
| Cell Type | Most Dividing | Most Dividing/Non-Dividing Cells | Most Dividing/Non-Dividing Cells | Most Dividing/Non-Dividing Cells |
| Titer | 10^7 TU/ml | 10^8 TU/ml | 10^11 PFU/ml | 10^12 vg/ml |
| Animal experiment | Suitable | Low efficiency | Lowest efficiency | Most suitable |
| Immune Response | High | Medium | Medium | Ultra-low |
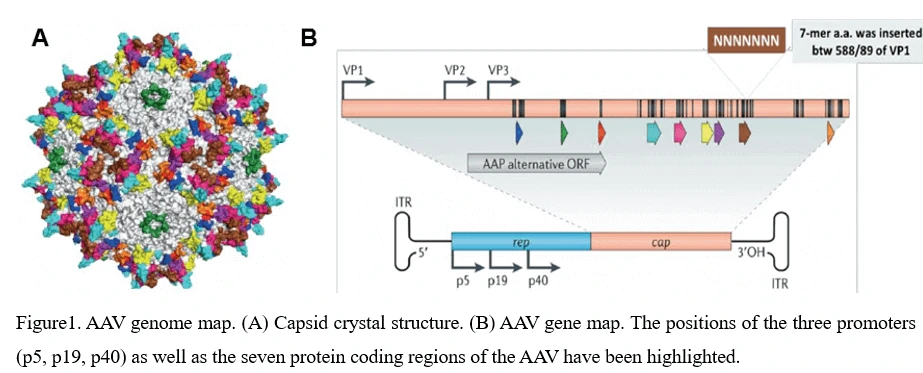
4. AAVのゲノム構造(ITR、Rep、Cap、VP1、VP2、VP3)およびAAVウイルスの組み立て
AAVのシェルは直径約25nmで、4.7キロベースの一本鎖DNAゲノムをカプシドに封入しています。ゲノムは、AAVゲノムの複製とパッケージングに必要な唯一のシス作用因子である145bpの反転末端反復配列(ITR)に挟まれた2つの大きなオープンリーディングフレーム(ORF)で構成されています。左側のORFは4つの複製タンパク質(Rep40、Rep52、Rep68、Rep78)をコードしており、これらはAAVゲノム内でのAAVカプシド形成開始の調整および特異的な統合に関与しています。右側のORFはウイルス構造タンパク質(VP1、VP2、VP3)をコードしており、これらは相互作用して60個のサブユニットからなる正二十面体のビリオンシェルを組み立てます(図1)。
5. AAVウイルスのライフサイクル - 感染から再生まで
AAVは以下の段階を経て細胞をトランスデュースします:(1)ウイルスが細胞表面の受容体/共受容体に結合する、(2)ウイルスのエンドサイトーシス、(3)エンドソームコンパートメントを通じたウイルスの細胞内輸送、(4)ウイルスのエンドソーム脱出、(5)核へのウイルスの細胞内輸送および核輸入、(6)ビリオンのアンコーティング、(7)ウイルスゲノムが一本鎖から二本鎖に変換され、コードされた遺伝子を発現できるようになる[34-36]。AAVはポリメラーゼをコードできないため、AAVは自身のゲノムを複製するために細胞のポリメラーゼ活性に依存しています[37]。アデノウイルスなどの補助ウイルスの存在は、野生型AAVの遺伝子発現および複製を促進するために不可欠です(図2A)。補助ウイルスがない場合、Rep68/Rep78の発現はP5プロモーターのYY1による抑制により制限され、AAVゲノムの複製および遺伝子発現が抑制され、AAV染色体の統合が開始されます(図2B)[38]。AAVは特定のゲノムサイト(アデノ随伴ウイルス統合サイト1、AAVS1)に特異的に統合することで潜伏性を確立します。このサイトは染色体19(q13.4)の4kb領域です。
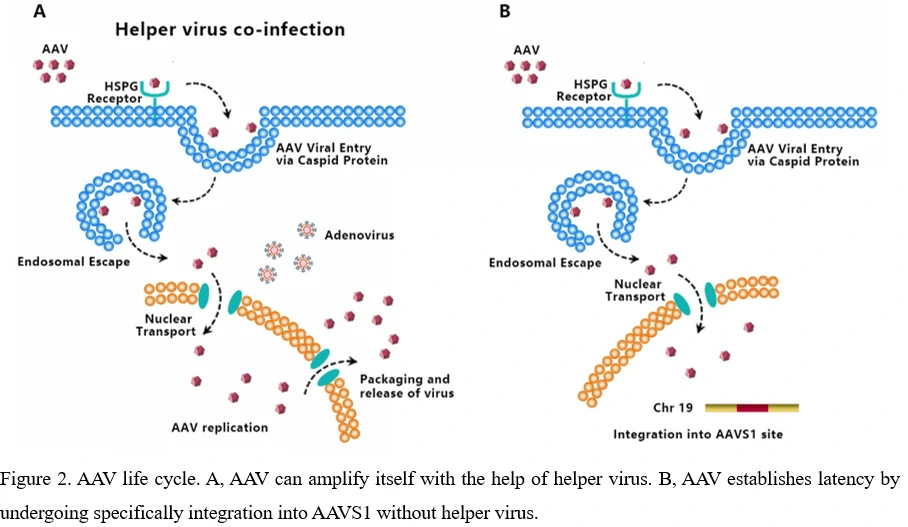
現在までに、AAVが関連する既知の病気は示されていませんが、多くの動物種の組織でAAVが検出されています。血清学的研究は、ほとんどの人が幼少期や思春期に野生型AAVにさらされており、成人の抗体力価の有病率が60%を超えることを示していますが、有害な影響や溶解感染は観察されていません[39,40]。
6. AAV血清型とAAV組織特異的嗜好性
過去数十年にわたり、多くのAAV血清型が識別され、さまざまな嗜好性が明らかにされています。現在までに、アデノウイルスストックやヒト/非ヒト霊長類の組織から12種類のAAV血清型と100種類以上のAAV変異体が分離されています。その中で、AAV2、AAV3、AAV5、AAV6はヒト細胞で発見され、AAV1、AAV4、AAV7、AAV8、AAV9、AAV10(AAVrh10)、AAV11、AAV12は非ヒト霊長類のサンプルで発見されました[41]。異なる血清型間のゲノム分岐は、ウイルスカプシドの高変異領域(HVR)に最も集中しており、これが組織嗜好性を決定する可能性があります[42]。ウイルスカプシドに加えて、AAVベクターの組織嗜好性は、細胞表面受容体、細胞内取り込み、細胞内処理、ベクターゲノムの核輸送、アンコーティング、および二本鎖DNA変換によっても影響されます[3]。組織のトランスダクションを効果的に実現するため、またはAAV嗜好性を特定の組織に制限するために、研究者はカスタムデザインのAAVカプシドを工学的に設計してモザイクAAVベクターやキメラAAVベクターを開発し、遺伝子治療を実施しています[43,44]。
a)AAV血清型2(AAV2)
AAV血清型2(AAV2)は最初に分離されたAAVであり、最も研究が進んでいるAAV血清型でもあります。AAV2は骨格筋[45]、神経細胞[46]、血管平滑筋細胞[47]、肝細胞[48]に対して自然嗜好性を持っています。AAV2は3つの受容体を持ち、その中でヘパラン硫酸プロテオグリカン(HSPG)はAAV粒子を捕捉し、感染効率を低下させる主要な受容体として機能します[49]。一方、αVβ5インテグリンおよび線維芽細胞増殖因子受容体1(FGFR-1)は、受容体媒介エンドサイトーシスを通じてAAVが細胞に侵入することを可能にする共受容体として機能します[50-52]。AAV2は、現在健康な細胞に影響を与えることなく、卵巣癌(OvCa)などの癌治療に使用されています[53]。
b)AAV血清型8(AAV8)およびAAV血清型9(AAV9)
AAV2に加えて、最も広く使用されているAAV血清型はAAV8およびAAV9です。AAV8は肝臓への遺伝子導入のための強力なベクターであり、他の多くの血清型よりも高い効率でさまざまな標的臓器に遺伝子を導入するための有望な研究ツールです。実験では、全身注射後に肝臓、骨格筋、心臓の効率的なトランスダクションが検出されました[54]。さらに重要なのは、AAV8の単一の尾静脈注射がどの用量でも門脈注射と同等に効率的であり、高用量のAAV8が全身の骨格筋をトランスダクションし、横隔膜、全心筋、膵臓、平滑筋、および脳をかなりのレベルでトランスダクションしたことです[55]。AAV2と比較して、AAV9は広範なトランスダクションプロファイルを示し、効率はさらに高い[56]。さらに、AAV9は血液脳関門(BBB)を回避する能力があり、血管内投与が非侵襲的な投与ルートとして広範なCNS遺伝子発現を達成するために使用されることを可能にします。さらに、AAV9の静脈内遺伝子導入は、リソソーム蓄積障害や運動ニューロン病などのいくつかの疾患に対して動物モデルで有望な結果を示しており、この分野での最初の臨床試験への道を開いています[57]。
c)その他のAAV血清型
今日では、12種類のAAV血清型が遺伝子導入ベクターとして設計されています。ベクターティターと投与量、プロモーター、およびトランスジーンの間の研究間の変動のため、AAV血清型の組織嗜好性を解釈するのは難しいかもしれません。主要な組織および細胞タイプにおけるトランスダクション効率の一般的な階層が表1および表2に確立されています。例えば、AAV2は中枢神経系、肝臓、筋肉、および肺を含むいくつかの組織タイプを中程度にトランスダクションすることができます。同様に、CNS内では、AAV1およびAAV5は注入されたすべての領域でAAV2よりも高いトランスダクション頻度を示します[58,59]。一方、AAV4は特定の細胞タイプ、例えば側脳室帯の星状細胞および上衣細胞をトランスダクションするようです[60]。骨格筋細胞では、AAV1、AAV6、およびAAV7が非常に高いトランスダクション率を示すと報告されています[56,61-63]。一方、AAV8は肝細胞だけでなく他の臓器でも非常に高い効率でトランスダクション能力を示します[44,61,64]。骨格筋細胞に加えて、AAV6はAAV2と比較してマウス肺の気道上皮細胞のより効率的なトランスダクションを媒介することが報告されており、これはAAV6がAAV2よりも低い免疫原性を持つことを考慮すると、嚢胞性線維症などの肺疾患の遺伝子治療に対してAAV2よりも大きな利点を提供するかもしれません[44,61]。
| AAV Serotype | Tissue tropism | |||||||
| CNS | Retina | Lung | Liver | Pancreas | Kidney | Heart | Muscle | |
| AAV1 | √ | √ | √ | √ | √ | |||
| AAV2 | √ | √ | √ | |||||
| AAV3 | √ | √ | √ | √ | ||||
| AAV4 | √ | √ | √ | |||||
| AAV5 | √ | √ | √ | √ | ||||
| AAV6 | √ | √ | √ | √ | √ | |||
| AAV7 | √ | √ | ||||||
| AAV8 | √ | √ | √ | √ | ||||
| AAV9 | √ | √ | √ | √ | √ | |||
| AAV-DJ | √ | √ | √ | √ | ||||
| AAV-DJ/8 | √ | √ | √ | |||||
| AAV-Rh10 | √ | √ | √ | √ | √ | |||
| AAV-retro | √ | √ | √ | |||||
| AAV-PHP.B | √ | √ | √ | |||||
| AAV8-PHP.eB | √ | √ | ||||||
| AAV-PHP.S | √ | √ | √ | |||||
| Cell Line | AAV1 | AAV2 | AAV3 | AAV4 | AAV5 | AAV6 | AAV8 | AAV9 | AAV-DJ | AAV-DJ/8 |
| Huh-7 | 13 | 100 | 2.5 | 0 | 0.1 | 10 | 0.7 | 0 | 500 | 0.2 |
| HEK293 | 25 | 100 | 2.5 | 0.1 | 0.1 | 5 | 0.7 | 0.1 | 500 | 0.3 |
| Hela | 3 | 100 | 2 | 0.1 | 6.7 | 1 | 0.2 | 0.1 | 667 | 0.2 |
| HepG2 | 3 | 100 | 16.7 | 0.3 | 1.7 | 5 | 0.3 | ND | 1250 | 0.5 |
| Hep1A | 20 | 100 | 0.2 | 1 | 0.1 | 1 | 0.2 | 0 | 400 | 0.1 |
| 911 | 17 | 100 | 11 | 0.2 | 0.1 | 17 | 0.1 | ND | 500 | 0 |
| CHO | 100 | 100 | 14 | 1.4 | 333 | 50 | 10 | 1 | 25000 | 5 |
| COS | 33 | 100 | 33 | 3.3 | 5 | 14 | 2 | 0.5 | 500 | 0.3 |
| MeWo | 10 | 100 | 20 | 0.3 | 6.7 | 10 | 1 | 0.2 | 2857 | 1 |
| NIH3T3 | 10 | 100 | 2.9 | 2.9 | 0.3 | 10 | 0.3 | ND | 500 | 0.1 |
| A549 | 14 | 100 | 20 | ND | 0.5 | 10 | 0.5 | 0.1 | 1000 | 0.1 |
| HT1180 | 20 | 100 | 10 | 0.1 | 0.3 | 33 | 0.5 | 0.1 | 333 | 0.2 |
| Monocytes | 1111 | 100 | ND | ND | 125 | 1429 | ND | ND | 100 | ND |
| Immature DC | 2500 | 100 | ND | ND | 222 | 2857 | ND | ND | 200 | ND |
| Mature DC | 2222 | 100 | ND | ND | 333 | 3333 | ND | ND | 100 | ND |
7. AAVベクターシステム(AAV Vector System)
a)rAAVベクターシステムの紹介
野生型AAVは人間の病気と関連していないにもかかわらず、自然に欠陥があり、AAV複製にはアデノウイルスや単純ヘルペスウイルス(HSV)との共感染が必要であるため、組換えAAV(rAAV)は遺伝子治療の魅力的なベクターとなっています。1984年に、rAAVはウイルスゲノムをトランスジーンに置き換えて初めて使用され、その後、アデノウイルスに感染した細胞にトランスフェクトされてrAAVが生成されました。
従来、臨床試験で使用されるrAAVベクターは、AAVの反転末端リピート(ITR)で挟まれた治療用遺伝子を含むプラスミドと、AAVパッケージングプラスミドAAV-RC(AAV複製およびAAVカプシド)およびpHelper(AAVヘルパープラスミド)と共にトランスフェクトされて準備されました。アデノウイルスヘルパー因子、例えばE1A、E1B、E2A、E4ORF6、およびVA RNAは、3番目のヘルパープラスミドによって提供されます。一般的に使用されるAAV生産細胞であるHEK293細胞には既にE1A/E1B遺伝子が含まれているため、ヘルパープラスミドによって提供されるのはE2A、E4ORF6、およびVA RNAのみです。
b)ヘルパーフリーrAAVシステム
現在のrAAV生産方法は、AAV生産に必要なすべての要素を宿主細胞(HEK293細胞など)に一過性トランスフェクションするアデノウイルスフリーの方法に基づいています。これは、図3に示されるように、AAV生産細胞に3つのプラスミドを共トランスフェクトすることを含みます。
1. AAV-GOI:関心のある遺伝子(GOI)を運ぶAAV ITR含有プラスミド;
2. AAV-RC:RepおよびCapsid遺伝子を運ぶAAVセロタイププラスミド;
3. pHelper:アデノウイルスから分離されたヘルパー遺伝子を提供するAAVヘルパープラスミド。
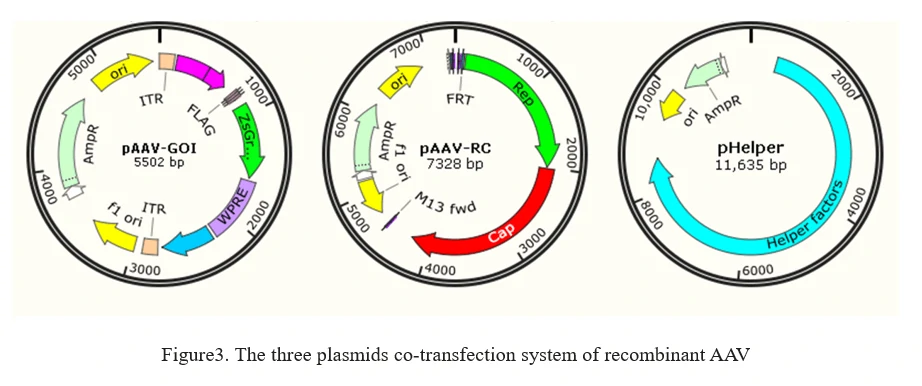
8. AAVエンジニアリング(AAVカプシド進化)
AAVカプシドの再設計の詳細を見るにはここをクリック>>
自然界では100種類以上のAAVセロタイプの変異体が発見されていますが、rAAV生産のための重大な進歩が見られ、動物や霊長類のいくつかの組織および細胞タイプに対するトランスダクション効率および特異性が低いです。AAVによる非標的デリバリーは高用量を必要とし、潜在的な毒性、問題のある製造負担、そして最適でない有効性を引き起こす可能性があります。したがって、AAVをベクターとして開発する重要な領域は、rAAVによる遺伝子デリバリー効率および特異性を向上させるために、細胞トロピズムの変更をエンジニアリングすることに関係しています。さまざまなAAVセロタイプの中で、トランスダクション効率の変動は、標的細胞上の各々の受容体の内容の違いによって引き起こされる可能性があります。
AAVデリバリー効率および特異性を改善するための多数の戦略が開発されました。方法論的には、AAVトロピズムおよび特異性を改善する方法は2つのカテゴリに分けられます。1つは、異なるウイルス間でのタンパク質の組み立てと再組み換えであり、これによりハイブリッドrAAVが生成される可能性があります。もう1つは、AAVのカプシドタンパク質にさまざまな方法で再組み換え、再設計、またはランダム変異を導入して、AAVセロタイプのバリエーションを人工的に増やし、適切なAAVセロタイプを選別することです。
a)ハイブリッドrAAVベクター
ハイブリッドrAAVベクターを生成するために一般的に使用されるアプローチは、異なるセロタイプのカプシドにITRをパッケージ化するプロセスであるトランスカプシデーションです。これは、ハイブリッドの組織トロピズムを決定する可能性があります。たとえば、上記のヘルパーフリーシステムに基づいてrAAV2/5を生成する場合、AAVパッケージングプラスミドAAV-RCはpRep2/Cap5である必要があります。つまり、Rep遺伝子はAAV2に由来し、カプシド遺伝子はAAV5に由来します。パッケージングスキームは、AAV2生産のための上記のアプローチと同じです。生成されたrAAVはrAAV2/5と呼ばれ、このウイルスの組織トロピズムはAAV5と同じと見なされます。
b)AAV進化
AAVを進化させる主な方法は2つあります。1つは合理的設計で、もう1つは直接進化です(図4)。
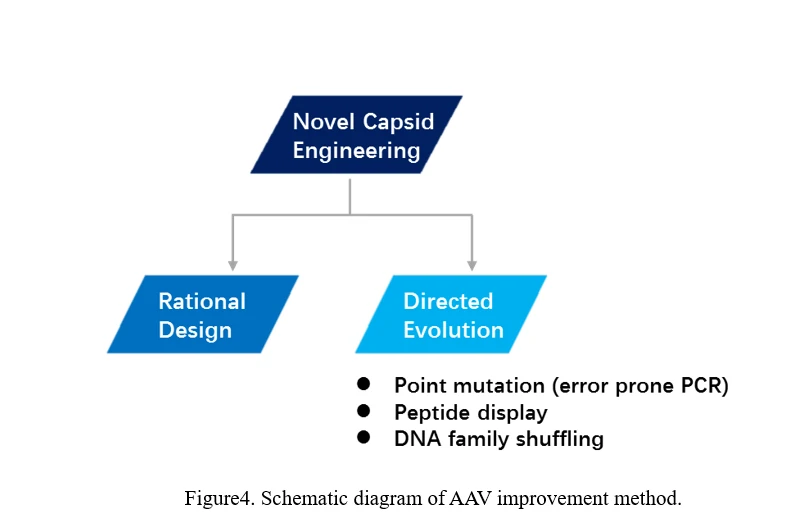
合理的設計
合理的設計AAVカプシドの一般的な方法のいくつかは、デリバリーメカニズムに関する知識とAAV構造解析に基づいています[65]。以下にリストされている。
(1) AAVカプシドのチロシン残基のリン酸化はユビキチン化を引き起こし、AAVビリオンのプロテアソーム分解を促進し、部位特異的変異導入によってチロシンをフェニルアラニンに変異させるベクターの作成に至ります[66]。
(2) マウスIgG2a抗体のAAV2表面へのドッキング部位を解析し、立体的にアクセス可能な候補位置を特定し、その後広範な部位特異的変異導入を行って、in vitroで抗体による中和を減少させる変異体を開発しました[67]。
(3) AAVカプシドに高親和性リガンドを組み込むことで、代替細胞表面受容体に結合し、ウイルストロピズムを制限または再方向付けることができます[68]。
AAV直接進化
従来の直接進化プロセスは、最初にエラープローンPCR、ペプチドディスプレイ、またはDNAファミリーシャッフリングによってライブラリーを生成します。次に、このAAVウイルスライブラリーをプールとしてパッケージ化し、精製し、in vitroまたはin vivoで一定の圧力下で選択されます。標的細胞または組織への感染後、ウイルスはアデノウイルスによる複製またはPCR増幅から回収されます。3回以上の選択後、高い感染力と特異性を持つAAVカプシド種が濃縮されます(図5)[69]。
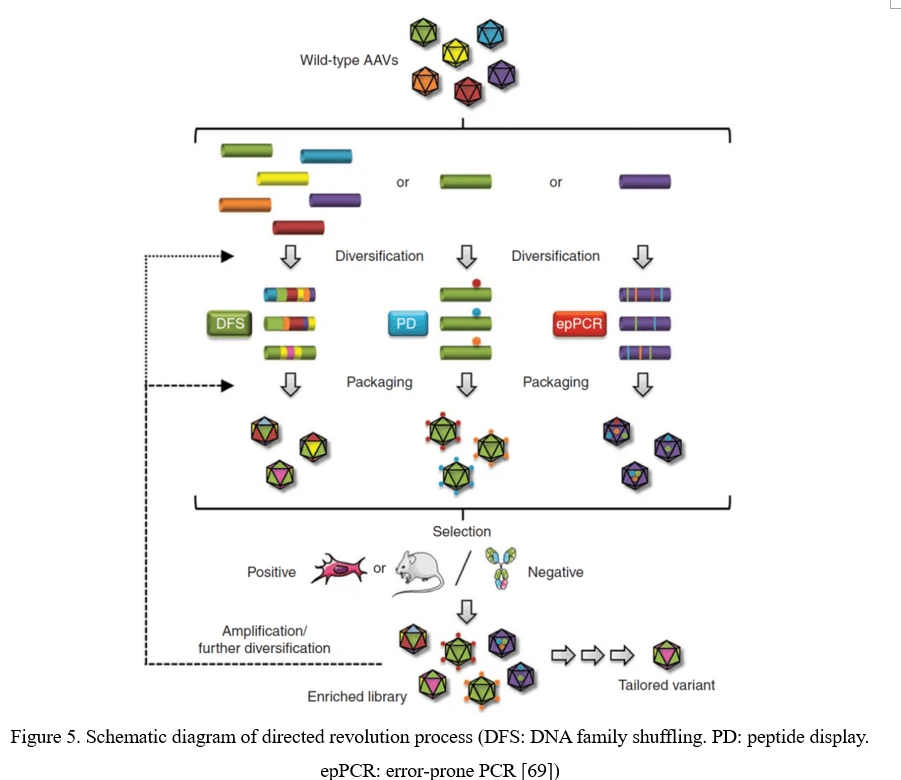
点突然変異(エラープローンPCR)
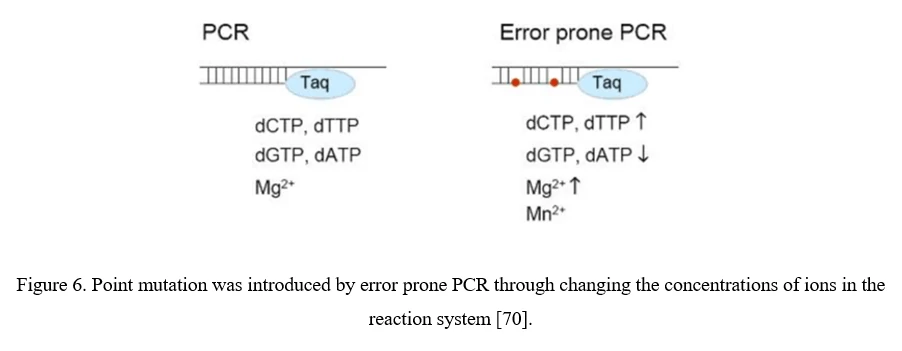
AAV多様化の最も単純な戦略は、AAVウイルスカプシドの個々の残基を部位特異的またはランダムな方法で突然変異させ、期待されるアミノ酸の変化がAAVベクターの特性を変更することです。ランダムな突然変異はエラープローンPCRでAAVカプシドをコードする配列に導入することができます(図6)。
点突然変異はAAVカプシドをコードする配列に簡単に導入できますが、問題も存在します。1)AAV変異のうち、有益なものは通常0.01〜1%のみです。2)現在のところ、単一のAAVカプシド内で複数の突然変異のすべての組み合わせをカバーするクローン数は技術的に可能性を超えています。AAVカプシドの特定の領域、特に細胞受容体や抗体と相互作用する可能性が高い表面に露出した領域やAAVカプシドの突起に焦点を当てる方が有用です[70]。
ペプチドディスプレイ
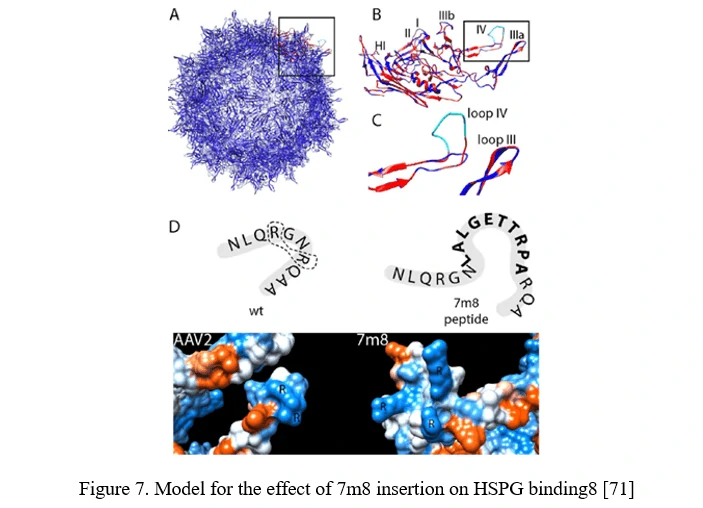
AAVカプシド表面に新しい受容体結合要素を挿入することで、特定の細胞タイプに特異的に発現する受容体に対する親和性を提供できます。このAAVペプチドディスプレイ戦略の成功を最大化するためには、ペプチドの表面露出を媒介するAAVカプシドの部位を活用することが重要です。
AAV2の場合、これはHSPGへの結合に必要な2つの重要な残基の1つであるアルギニン588(R588)の前または後に挿入することで達成できます。AAV2-7m8変異体では、7m8がHSPG結合モチーフを破壊し、アルギニンを分離します(図7)[71]。
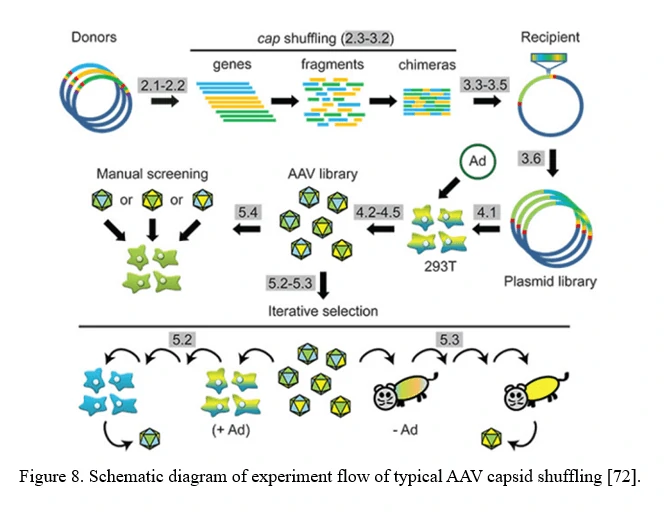
AAVファミリーシャッフリング(AAVカプシドのDNAシャッフリング)
キメラカプシドをコードするライブラリーは、AAVファミリーシャッフリングによって生成されることがあります(図8)。さまざまなAAVカプシド遺伝子の断片は、部分的な相同性(通常はほとんどのAAVセロタイプで> 80%)に基づいて再構築されます。このライブラリーには、細胞トロピズムと中和抗体耐性に幅広い多様性を持つキメラが含まれています。
このアプローチは、新たに特定されたAAVセロタイプや合理的に設計されたAAVカプシド変異体の機能を活用し、組み合わせて、無限の数の新しい特性を持つ新規な変異体を作成する可能性があります[72]。
9. AAVベクターのトランスダクション - AAVベクターのin vivo遺伝子デリバリー
心臓、肝臓、腎臓、乳房、膵臓、卵巣、脳、眼、骨格筋、脂肪組織などの正常な組織や臓器に対して、GeneMediは、マウスやラットの組織感染に最適な対応するAAVセロタイプ、遺伝子デリバリー方法、および注入量を体系的に整理しています。さまざまな臓器のための推奨されるAAV遺伝子デリバリー方法は、表5に示されています。
| Infection organ | Recommended serotype | Injection route | Animal | Injection volume (μl) |
| Heart | AAV9 | Multiple points in situ | Rat | 10-15/point, 3-5 points |
| Mouse | 10-15/point, 3-5 points | |||
| Tail vein | Rat | 250 (200g body weight) | ||
| Mouse | 100 | |||
| Liver | AAV8 or AAV9 | Tail vein | Rat | 200 (200g body weight) |
| Mouse | 100 | |||
| Whole brain | AAV-PHP.eB AAV-PHP.B | Tail vein | Rat | 200 (200g body weight) |
| Mouse | 100 | |||
| Lateral ventricle | AAV9 | Stereotactic | Rat | 1-5 |
| Mouse | 1-5 | |||
| Brain tissue | AAV9 | Stereotactic | Rat | 2-3 |
| Mouse | 1-2 | |||
| Fat | AAV9 | Intraperitoneal injection for intraperitoneal fat | Rat | 300 |
| Mouse | 150-200 | |||
| in situ injection for subcutaneous fat | Rat | 10-15/point, 3-5 points | ||
| Mouse | 10-15/point, 3-5 points | |||
| Skeletal muscle | AAV1 or AAV9 | In situ injection | Rat | 10-15/point, 3-5 points |
| Mouse | 10-15/point, 3-5 points | |||
| Eyes | AAV2, AAV10 or AAV-DJ | vitreous chamber injection | Rat | 3-5 |
| Mouse | 1-3 | |||
| subretinal space injection | Rat | 1-2 | ||
| Mouse | 1-2 | |||
| Lung | AAV6 | Intratracheal injection | Rat | 100 (200g weight) |
| Mouse | 50-75 | |||
| Kidney | AAV2 or AAV9 | Renal pelvis injection | Rat | 10-15/point, 3-5 points |
| Mouse | 10-15/point, 3-5 points | |||
| Intestine | AAV1 or AAV5 | Enema | Rat | 200 (200g weight) |
| Mouse | 100 |
詳細なAAVのin vivo動物注射プロトコルはAAVユーザーマニュアルに記載されています。
10. アデノ随伴ウイルス(AAVベクター) - 生産プロトコル、ガイドラインおよび参考文献
AAV生産プロトコル--Genemedi
1. AAVプラスミド構築
目的遺伝子は、ITR/MCSを含むAAVベクターの一つにクローニングされてAAV-GOIを生成します。AAVウイルスプラスミドの純度とRNAse汚染物質を考慮する必要があります。
2. AAVパッケージング
組換えAAVウイルスプラスミドAAV-GOIは、AAVヘルパープラスミドpHelper(アデノウイルス由来の遺伝子を運ぶ)およびAAV-RC(AAV-2複製およびカプシド遺伝子を運ぶ)と共にAAV-293細胞に共トランスフェクションされ、これらはAAV複製およびAAV-293細胞内でのパッケージングに必要な全てのトランスアクティング因子を供給します。
3. AAV粒子の収穫
細胞を収集し、細胞ペレットを凍結/解凍してAAVウイルスを放出します。
4. AAVの精製
不純なAAV調製物から汚染物質を分離するために、勾配超遠心分離を用いてAAVウイルスを精製します。
5. AAVタイターの検出
AAV ITRを標的とするプライマーを使用してリアルタイム定量PCR(QPCR)によってAAVタイターを決定します。タイター値は、既知濃度のプラスミドサンプルの標準曲線と比較して特定されます。
6. AAVの品質管理
AAVウイルスのタイター検出後、293T、CHOなどの細胞を感染させて遺伝子発現をテストし、動物実験前に感染活性を評価する必要があります。細胞でのAAV媒介遺伝子トランスダクションのためのMOIは10^4から10^5の範囲で制御されます。
Adeno-associated virus (AAV vector) - Guidelines
| NIH Guidelines for Adeno-Associated (AAV) Lentivirus and Adenovirus | Guidance for Gene Therapy Clinical trials-FDA | Human Gene Therapy for Hemophilia |
| Human Gene Therapy For Rare Diseases | Human Gene Therapy for Retinal Disorders |
1. Atchison RW, BC Casto and WM Hammon. (1965). Adenovirus-Associated Defective Virus Particles. Science 149:754-6.
2. Hoggan MD, NR Blacklow and WP Rowe. (1966). Studies of small DNA viruses found in various adenovirus preparations: physical, biological, and immunological characteristics. Proc Natl Acad Sci U S A 55:1467-74.
3. Wu Z, A Asokan and RJ Samulski. (2006). Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol Ther 14:316-27.
4. Vectors used in gene therapy clinical trials. The Journal of Gene Medicine Online Library. [Online] Updated Nov 2017. http://www.abedia.com/wiley/vectors.php.
5. Zsigmond E, K Kobayashi, KW Tzung, L Li, Y Fuke and L Chan.
(1997). Adenovirus-mediated gene transfer of human lipoprotein lipase ameliorates the hyperlipidemias associated with apolipoprotein E and LDL receptor deficiencies in mice. Hum Gene Ther 8:1921-33.
6. Passini MA, J Bu, AM Richards, CM Treleaven, JA Sullivan, CR O'Riordan, A Scaria, AP Kells, L Samaranch, W San Sebastian, T Federici, MS Fiandaca, NM Boulis, KS Bankiewicz, LS Shihabuddin and SH Cheng. (2014). Translational fidelity of intrathecal delivery of self-complementary AAV9-survival motor neuron 1 for spinal muscular atrophy. Hum Gene Ther 25:619-30.
7. Stieger K and B Lorenz. (2014). [Specific gene therapy for hereditary retinal dystrophies - an update]. Klin Monbl Augenheilkd 231:210-5.
8. Trapani I, P Colella, A Sommella, C Iodice, G Cesi, S de Simone, E Marrocco, S Rossi, M
Giunti, A Palfi, GJ Farrar, R Polishchuk and A Auricchio. (2014). Effective delivery of large genes to the retina by dual AAV vectors. EMBO Mol Med 6:194-211.
9. Doi K and Y Takeuchi. (2015). Gene therapy using retrovirus vectors: vector development and biosafety at clinical trials. Uirusu 65:27-36.
10. Duncan GA, N Kim, Y Colon-Cortes, J Rodriguez, M Mazur, SE Birket, SM Rowe, NE West, A Livraghi-Butrico, RC Boucher, J Hanes, G Aslanidi and JS Suk. (2018). An Adeno-Associated Viral Vector Capable of Penetrating the Mucus Barrier to Inhaled Gene Therapy. Mol Ther Methods Clin Dev 9:296-304.
11. Bowles DE, SW McPhee, C Li, SJ Gray, JJ Samulski, AS Camp, J Li, B Wang, PE Monahan, JE Rabinowitz, JC Grieger, L Govindasamy, M Agbandje-McKenna, X Xiao and RJ Samulski. (2012). Phase 1 gene
therapy for Duchenne muscular dystrophy using a translational optimized AAV vector. Mol Ther 20:443-55.
12. Nathwani AC, EG Tuddenham, S Rangarajan, C Rosales, J McIntosh, DC Linch, P Chowdary, A Riddell, AJ Pie, C Harrington, J O'Beirne, K Smith, J Pasi, B Glader, P Rustagi, CY Ng, MA Kay, J Zhou, Y Spence, CL Morton, J Allay, J Coleman, S Sleep, JM Cunningham, D Srivastava, E Basner-Tschakarjan, F Mingozzi, KA High, JT Gray, UM Reiss, AW Nienhuis and AM Davidoff. (2011). Adeno-associated virus vector-mediated gene transfer in hemophilia B. N Engl J Med 365:2357-65.
13. Jessup M, B Greenberg, D Mancini, T Cappola, DF Pauly, B Jaski, A Yaroshinsky, KM Zsebo, H Dittrich, RJ Hajjar and I Calcium Upregulation by Percutaneous Administration of Gene Therapy in Cardiac Disease. (2011). Calcium Upregulation by Percutaneous Administration of Gene
Therapy in Cardiac Disease (CUPID): a phase 2 trial of intracoronary gene therapy of sarcoplasmic reticulum Ca2+-ATPase in patients with advanced heart failure. Circulation 124:304-13.
14. LeWitt PA, AR Rezai, MA Leehey, SG Ojemann, AW Flaherty, EN Eskandar, SK Kostyk, K Thomas, A Sarkar, MS Siddiqui, SB Tatter, JM Schwalb, KL Poston, JM Henderson, RM Kurlan, IH Richard, L Van Meter, CV Sapan, MJ During, MG Kaplitt and A Feigin. (2011). AAV2-GAD gene therapy for advanced Parkinson's disease: a double-blind, sham-surgery controlled, randomised trial. Lancet Neurol 10:309-19.
15. Mease PJ, N Wei, EJ Fudman, AJ Kivitz, J Schechtman, RG Trapp, KF Hobbs, M Greenwald, A Hou, SA Bookbinder, GE Graham, CW Wiesenhutter, L Willis, EM Ruderman, JZ Forstot, MJ Maricic, KH Dao, CH Pritchard, DN Fiske, FX Burch, HM Prupas, P Anklesaria and AE Heald. (2010).
Safety, tolerability, and clinical outcomes after intraarticular injection of a recombinant adeno-associated vector containing a tumor necrosis factor antagonist gene: results of a phase 1/2 Study. J Rheumatol 37:692-703.
16. Evans CH, SC Ghivizzani and PD Robbins. (2018). Gene Delivery to Joints by Intra-Articular Injection. Hum Gene Ther 29:2-14.
17. Gupta PR and RM Huckfeldt. (2017). Gene therapy for inherited retinal degenerations: initial successes and future challenges. J Neural Eng 14:051002.
18. Polinski NK, SE Gombash, FP Manfredsson, JW Lipton, CJ Kemp, A Cole-Strauss, NM Kanaan, K Steece-Collier, NC Kuhn, SL Wohlgenant and CE Sortwell. (2015). Recombinant adenoassociated virus 2/5-mediated gene transfer is reduced in the aged rat midbrain. Neurobiol Aging 36:1110-20.
19. Moore T. (2005). Restoring retinal function in a mouse model of hereditary blindness. PLoS Med 2:e399.
20. Russell S, J Bennett, JA Wellman, DC Chung, ZF Yu, A Tillman, J Wittes, J Pappas, O Elci, S McCague, D Cross, KA Marshall, J Walshire, TL Kehoe, H Reichert, M Davis, L Raffini, LA George, FP Hudson, L Dingfield, X Zhu, JA Haller, EH Sohn, VB Mahajan, W Pfeifer, M Weckmann, C Johnson, D Gewaily, A Drack, E Stone, K Wachtel, F Simonelli, BP Leroy, JF Wright, KA High and AM Maguire. (2017). Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: a randomised, controlled, open-label, phase 3 trial. Lancet 390:849-860.
21. Dulsat C. (2017). American Academy of Neurology - 69th Annual Meeting (April 22-28, 2017 - Boston, Massachusetts,
USA). Drugs Today (Barc) 53:309-319.
22. Annexstad EJ, I Lund-Petersen and M Rasmussen. (2014). Duchenne muscular dystrophy. Tidsskr Nor Laegeforen 134:1361-4.
23. Blankinship MJ, P Gregorevic and JS Chamberlain. (2006). Gene therapy strategies for Duchenne muscular dystrophy utilizing recombinant adeno-associated virus vectors. Mol Ther 13:241-9.
24. Kawecka K, M Theodoulides, Y Hasoglu, S Jarmin, H Kymalainen, A Le-Heron, L Popplewell, A Malerba, G Dickson and T Athanasopoulos. (2015). Adeno-Associated Virus (AAV) Mediated Dystrophin Gene Transfer Studies and Exon Skipping Strategies for Duchenne Muscular Dystrophy (DMD). Curr Gene Ther 15:395-415.
25. Kodippili K, CH Hakim, X Pan, HT Yang, Y Yue, Y Zhang, JH Shin, NN Yang and D
Duan. (2018). Dual AAV Gene Therapy for Duchenne Muscular Dystrophy with a 7-kb Mini-Dystrophin Gene in the Canine Model. Hum Gene Ther 29:299-311.
26. Duan D. (2018). Systemic AAV Micro-dystrophin Gene Therapy for Duchenne Muscular Dystrophy. Mol Ther 26:2337-2356.
27. Santagostino E and MR Fasulo. (2013). Hemophilia a and hemophilia B: different types of diseases? Semin Thromb Hemost 39:697-701.
28. Nichols T, MH Whitford, VR Arruda, HH Stedman, MA Kay and KA High. (2014). Translational Data from AAV-Mediated Gene Therapy of Hemophilia B in Dogs. Hum Gene Ther Clin Dev.
29. Crudele JM, JD Finn, JI Siner, NB Martin, GP Niemeyer, S Zhou, F Mingozzi, CD Lothrop, Jr. and VR Arruda. (2015). AAV liver expression of FIX-Padua prevents and
eradicates FIX inhibitor without increasing thrombogenicity in hemophilia B dogs and mice. Blood 125:1553-61.
30. Hasbrouck NC and KA High. (2008). AAV-mediated gene transfer for the treatment of hemophilia B: problems and prospects. Gene Ther 15:870-5.
31. Brimble MA, UM Reiss, AC Nathwani and AM Davidoff. (2016). New and improved AAVenues: current status of hemophilia B gene therapy. Expert Opin Biol Ther 16:79-92.
32. Grieger JC and RJ Samulski. (2005). Packaging capacity of adeno-associated virus serotypes: impact of larger genomes on infectivity and postentry steps. J Virol 79:9933-44.
33. Selot RS, S Hareendran and GR Jayandharan. (2014). Developing immunologically inert adeno-associated virus (AAV) vectors for gene therapy:
possibilities and limitations. Curr Pharm Biotechnol 14:1072-82.
34. Bartlett JS, R Wilcher and RJ Samulski. (2000). Infectious entry pathway of adeno-associated virus and adeno-associated virus vectors. J Virol 74:2777-85.
35. Ding W, L Zhang, Z Yan and JF Engelhardt. (2005). Intracellular trafficking of adeno-associated viral vectors. Gene Ther 12:873-80.
36. Srivastava A. (2008). Adeno-associated virus-mediated gene transfer. J Cell Biochem 105:17-24.
37. Berns KI. (1990). Parvovirus replication. Microbiol Rev 54:316-29.
38. Pereira DJ, DM McCarty and N Muzyczka. (1997). The adeno-associated virus (AAV) Rep protein acts as both a repressor and an activator to regulate AAV
transcription during a productive infection. J Virol 71:1079-88.
39. Calcedo R and JM Wilson. (2013). Humoral Immune Response to AAV. Front Immunol 4:341.
40. Mingozzi F and KA High. (2013). Immune responses to AAV vectors: overcoming barriers to successful gene therapy. Blood 122:23-36.
41. Weitzman MD and RM Linden. (2011). Adeno-associated virus biology. Methods Mol Biol 807:1-23.
42. Gao G, MR Alvira, S Somanathan, Y Lu, LH Vandenberghe, JJ Rux, R Calcedo, J Sanmiguel, Z Abbas and JM Wilson. (2003). Adeno-associated viruses undergo substantial evolution in primates during natural infections. Proc Natl Acad Sci U S A 100:6081-6.
43. Hauck B, L Chen and W Xiao. (2003).
Generation and characterization of chimeric recombinant AAV vectors. Mol Ther 7:419-25.
44. Rabinowitz JE, DE Bowles, SM Faust, JG Ledford, SE Cunningham and RJ Samulski. (2004). Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol 78:4421-32.
45. Manno CS, AJ Chew, S Hutchison, PJ Larson, RW Herzog, VR Arruda, SJ Tai, MV Ragni, A Thompson, M Ozelo, LB Couto, DG Leonard, FA Johnson, A McClelland, C Scallan, E Skarsgard, AW Flake, MA Kay, KA High and B Glader. (2003). AAV-mediated factor IX gene transfer to skeletal muscle in patients with severe hemophilia B. Blood 101:2963-72.
46. Bartlett JS, RJ Samulski and TJ McCown. (1998). Selective and rapid uptake of adeno-associated virus type 2 in brain. Hum Gene Ther
9:1181-6.
47. Richter M, A Iwata, J Nyhuis, Y Nitta, AD Miller, CL Halbert and MD Allen. (2000). Adeno-associated virus vector transduction of vascular smooth muscle cells in vivo. Physiol Genomics 2:117-27.
48. Koeberl DD, IE Alexander, CL Halbert, DW Russell and AD Miller. (1997). Persistent expression of human clotting factor IX from mouse liver after intravenous injection of adeno-associated virus vectors. Proc Natl Acad Sci U S A 94:1426-31.
49. Pajusola K, M Gruchala, H Joch, TF Luscher, S Yla-Herttuala and H Bueler. (2002). Cell-type-specific characteristics modulate the transduction efficiency of adeno-associated virus type 2 and restrain infection of endothelial cells. J Virol 76:11530-40.
50. Qing K, C Mah, J Hansen, S Zhou,
V Dwarki and A Srivastava. (1999). Human fibroblast growth factor receptor 1 is a co-receptor for infection by adeno-associated virus 2. Nat Med 5:71-7.
51. Summerford C and RJ Samulski. (1998). Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol 72:1438-45.
52. Summerford C, JS Bartlett and RJ Samulski. (1999). AlphaVbeta5 integrin: a co-receptor for adeno-associated virus type 2 infection. Nat Med 5:78-82.
53. Shi W, A Hemminki and JS Bartlett. (2006). Capsid modifications overcome low heterogeneous expression of heparan sulfate proteoglycan that limits AAV2-mediated gene transfer and therapeutic efficacy in human ovarian carcinoma. Gynecol Oncol 103:1054-62.
54. Wang Z,
T Zhu, C Qiao, L Zhou, B Wang, J Zhang, C Chen, J Li and X Xiao. (2005). Adeno-associated virus serotype 8 efficiently delivers genes to muscle and heart. Nat Biotechnol 23:321-8.
55. Nakai H, S Fuess, TA Storm, S Muramatsu, Y Nara and MA Kay. (2005). Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. J Virol 79:214-24.
56. Gao G, LH Vandenberghe, MR Alvira, Y Lu, R Calcedo, X Zhou and JM Wilson. (2004). Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol 78:6381-8.
57. Saraiva J, RJ Nobre and L Pereira de Almeida. (2016). Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. J Control Release 241:94-109.
58. Alisky JM, SM Hughes, SL
Sauter, D Jolly, TW Dubensky, Jr., PD Staber, JA Chiorini and BL Davidson. (2000). Transduction of murine cerebellar neurons with recombinant FIV and AAV5 vectors. Neuroreport 11:2669-73.
59. Burger C, OS Gorbatyuk, MJ Velardo, CS Peden, P Williams, S Zolotukhin, PJ Reier, RJ Mandel and N Muzyczka. (2004). Recombinant AAV viral vectors pseudotyped with viral capsids from serotypes 1, 2, and 5 display differential efficiency and cell tropism after delivery to different regions of the central nervous system. Mol Ther 10:302-17.
60. Davidson BL, CS Stein, JA Heth, I Martins, RM Kotin, TA Derksen, J Zabner, A Ghodsi and JA Chiorini. (2000). Recombinant adeno-associated virus type 2, 4, and 5 vectors: transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci U S A 97:3428-32.
61. Gao GP, MR Alvira, L Wang, R Calcedo, J Johnston and JM Wilson. (2002). Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy. Proc Natl Acad Sci U S A 99:11854-9.
62. Chao H, Y Liu, J Rabinowitz, C Li, RJ Samulski and CE Walsh. (2000). Several log increase in therapeutic transgene delivery by distinct adeno-associated viral serotype vectors. Mol Ther 2:619-23.
63. Blankinship MJ, P Gregorevic, JM Allen, SQ Harper, H Harper, CL Halbert, AD Miller and JS Chamberlain. (2004). Efficient transduction of skeletal muscle using vectors based on adeno-associated virus serotype 6. Mol Ther 10:671-8.
64. Halbert CL, JM Allen and AD Miller. (2001). Adeno-associated virus type 6 (AAV6) vectors mediate efficient transduction of
airway epithelial cells in mouse lungs compared to that of AAV2 vectors. J Virol 75:6615-24.
65. Kotterman MA and DV Schaffer. (2014). Engineering adeno-associated viruses for clinical gene therapy. Nat Rev Genet 15:445-51.
66. Zhong L, B Li, CS Mah, L Govindasamy, M Agbandje-McKenna, M Cooper, RW Herzog, I Zolotukhin, KH Warrington, Jr., KA Weigel-Van Aken, JA Hobbs, S Zolotukhin, N Muzyczka and A Srivastava. (2008). Next generation of adeno-associated virus 2 vectors: point mutations in tyrosines lead to high-efficiency transduction at lower doses. Proc Natl Acad Sci U S A 105:7827-32.
67. Lochrie MA, GP Tatsuno, B Christie, JW McDonnell, S Zhou, R Surosky, GF Pierce and P Colosi. (2006). Mutations on the external surfaces of adeno-associated virus type 2 capsids that affect transduction
and neutralization. J Virol 80:821-34.
68. Munch RC, H Janicki, I Volker, A Rasbach, M Hallek, H Buning and CJ Buchholz. (2013). Displaying high-affinity ligands on adeno-associated viral vectors enables tumor cell-specific and safe gene transfer. Mol Ther 21:109-18.
69. Grimm D and S Zolotukhin. (2015). E Pluribus Unum: 50 Years of Research, Millions of Viruses, and One Goal--Tailored Acceleration of AAV Evolution. Mol Ther 23:1819-31.
70. Maheshri N, JT Koerber, BK Kaspar and DV Schaffer. (2006). Directed evolution of adeno-associated virus yields enhanced gene delivery vectors. Nat Biotechnol 24:198-204.
71. Khabou H, M Desrosiers, C Winckler, S Fouquet, G Auregan, AP Bemelmans, JA Sahel and D Dalkara. (2016). Insight into the
mechanisms of enhanced retinal transduction by the engineered AAV2 capsid variant -7m8. Biotechnol Bioeng 113:2712-2724.
72. Kienle E, E Senis, K Borner, D Niopek, E Wiedtke, S Grosse and D Grimm. (2012). Engineering and evolution of synthetic adeno-associated virus (AAV) gene therapy vectors via DNA family shuffling. J Vis Exp.
Other knowledge bases
| AAV Knowledge Base | Adenovirus Knowledge Base | Lentivirus Knowledge Base |







 Facebook
Facebook LinkedIn
LinkedIn Twitter
Twitter
