抗体薬物複合体(Antibody-Drug Conjugate, ADC)の主要要素:リンカー(切断可能/切断不可能、構造と機構)
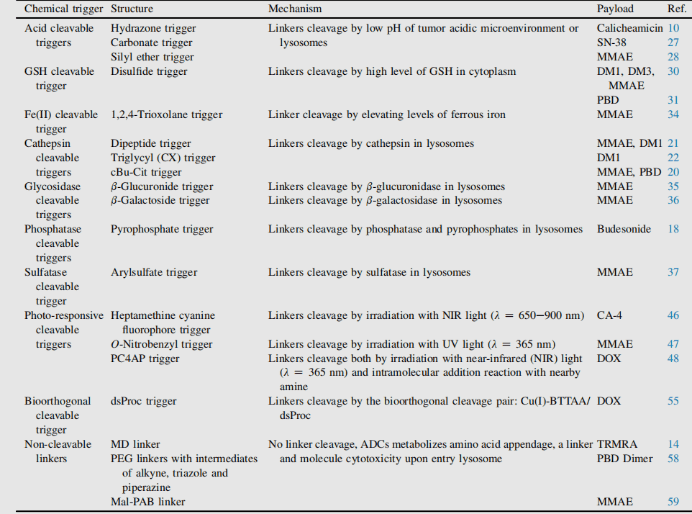
複合体リンカーは、抗体と小分子ペイロード(payload)の間に共有結合を形成する分子部分であると同時に、標的薬物療法における設計上の重要な要素です。リンカーの付加は凝集(aggregation)を誘発してはならず、許容できる薬物動態(pharmacokinetics, PK)の特性を確保し、血漿中でのペイロードの早期放出(安定性)を制限するとともに、標的作用部位で能動性分子を効果的に放出できることが必要です。接続過程において、複数の製薬企業がリンカーの開発に取り組んでおり、リンカーは大きく切断不可能(non-cleavable)リンカーと切断可能(cleavable)リンカーに分類されます1。
切断不可能リンカーを用いたADCは、必ず細胞内取り込み(internalization)を経由し、抗体部分がライソソーム内のプロテアーゼによって分解されることで活性分子が放出されます。これまでに、数多くの未切断リンカーがADC開発において検討されており、最も代表的なものはn-サクシニミド-4-(n-マレイミドメチル)シクロヘキサン-1-カルボキシレート(SMCC, SMCC)で、Kadcyla®で使用されています2。
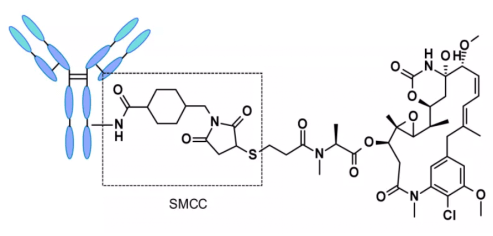
この構造の分解により、lys-smc-dm1が主要な腫瘍代謝物となります。さらに、このリンカーに結合した薬剤は、放出された代謝物が透過性に乏しいため、バイスタンダーキリング(bystander killing/bystander effect)が発現しにくいのが特徴です。現在の研究は主に切断可能リンカーに焦点が当てられています[6-7]。
切断可能リンカーは、内部取り込み型ADCおよび非内部取り込み型ADCの設計の両方に適用可能です。なぜなら、放出は切断部位(ライソソームおよび/または腫瘍環境)の性質によって引き起こされるためです。リンカーは、酵素依存性と化学的(非酵素依存性、すなわちnon-enzyme dependent)の2種類に大別され(どちらも複合体の製造に用いられます)、
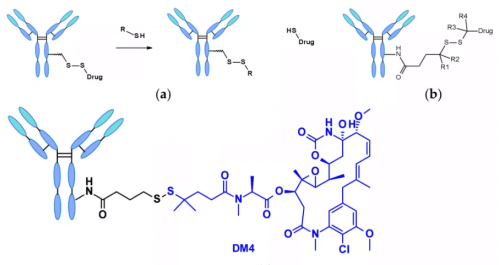
化学的依存性リンカー : ジスルフィド結合を含むリンカーは、メルカプタン(mercaptan)に攻撃されることで活性ペイロードが放出されます。血漿中で最も豊富なメルカプタンはヒト血清アルブミン(human serum albumin, HSA)の還元型ですが、大型分子に対する反応性は非常に低いです3。また、細胞質にはチオール基を含むトリペプチドであるグルタチオン(glutathione, GSH)が高濃度で存在し、S-求核性タンパク質と容易に反応します。血液中(マイクロモル濃度)と細胞質中(ミリモル濃度)のGSH濃度の違い、およびがん細胞による酸化ストレスが、がん細胞内での薬剤放出を優先させる要因となります。ジスルフィド結合を含むリンカーは主にメイタンシノイド系(maytansinoid)のペイロードに関連しており、ジスルフィド結合の反応性は立体障害(steric hindrance)によって調整可能です。例えば、α-メチル置換は還元速度およびメルカプタンによるジスルフィド交換への耐性に大きな影響を及ぼします。例として、sar-3419のリンカーは、ジメチル置換によりspdb-DM4の最良の抗腫瘍活性を実現しています。
ヒドラゾンリンカーはpH依存性の安定性を示し、中性pHでは安定で、酸性媒質(エンドソーム内pH<6、ライソソーム内pH<5)で加水分解し、対応するケトンおよびヒドラジンを形成します。
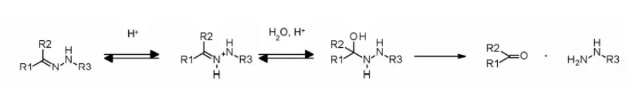
この手法は、ヒドラゾンリンカーを含むimmu-110に成功裏に適用されました。これは、4-マレイミドメチルシクロヘキサン-1-カルボキシレート(MCC, MCC)のヒドラジドとアドリアマイシンに存在するケトン基との反応により形成されます。
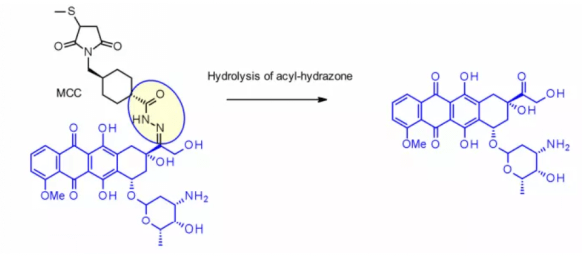
ヒドラゾンリンカーは、カリミシン系(calimycin family)のペイロードにも頻繁に使用されます。この場合、放出は2段階の活性化プロセスによって引き起こされます。第一段階では酸感受性ヒドラゾンが加水分解し、第二段階ではジスルフィド結合がGSHによって還元され、システリックなスルフヒド中間体が環化します。このリンカーは、Mylotarg®およびbesponsa®で使用されていますが、血漿中での安定性は期待ほど高くなく、他の切断可能リンカーほど魅力的ではありません。
酵素依存性リンカー : ペイロードの細胞内取り込み前の放出を制限し、標的細胞の分解を防ぐため、ライソソーム内のタンパク質成分が高濃度で存在する環境下で、ADCを分解可能な酵素が存在することが合理的です。
カテプシンB
カテプシンBは、哺乳類の高度なエンドソームおよびライソソームに存在し、多くのがん細胞で過剰発現しているシステインプロテアーゼです。初期には、切断可能なジペプチドがカテプシンBの基質として使用され、アドリアマイシンプロドラッグ(前薬)が開発されました。この研究により、SARのジペプチド部分では、P1位に親水性残基(シトルリンまたはアルギニン)が必要で、P2位に疎水性残基(フェニルアラニン、バリン、またはアラニン)を配置することで血漿安定性が向上することが示されました。
さらに、酵素の侵入を促進するために自己分解スペーサーが導入され、これによりペイロードの立体障害が制限されます。具体的には、酸性条件下でp-アミノベンジルカルバメート(PABA, PABA)の自発的1,6-エリミネーションが起こり、二酸化炭素、p-アザキノンホルミド、そしてアドリアマイシンが放出されます。この発見は、プロドラッグからADC分野へと応用され、Val-CitおよびPhe-Lysジペプチドリンカーの抗原駆動性細胞活性が実証されました4。
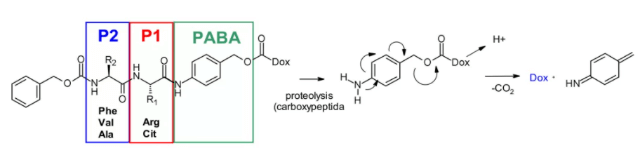
Val-Citジペプチドは、ADCで最も一般的に使用される切断可能リンカーです。現在、臨床段階にある分子は25種類に上り、その理由は全体として血漿安定性、放出挙動、および化学的操作性が良好であるためと考えられます。承認されたADC医薬品(例:Adcetris®、Polyvy®)は、マレイミドスペーサー、標準的なVal-Citジペプチド配列(カテプシン基質)およびPABC(p-アミノベンジルカルバメート, PABC)自己分解スペーサーを含む同一のリンカーMC VC PABCを使用しています。
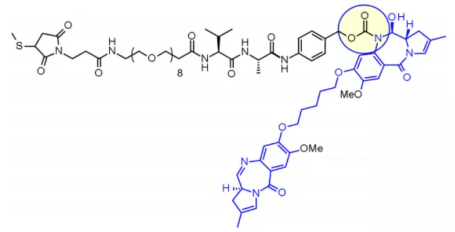
Val-Alaジペプチドも広く使用されています。現在、臨床段階では7種類の分子が存在しており、最速の進展例は、PBDダイマー系に属するペイロードsg3199の疎水性を緩和するためにPEG化スペーサーを組み込んだloncastuximab tesirineです。
研究によれば、Val-Citリンカーは沈殿や凝集を引き起こしやすいため高いDAR(Drug-to-Antibody Ratio, DAR)が得にくいのに対し、Val-Alaリンカーは凝集が限定的(< 10%)でDARが最大7.4まで達成可能です。Val-Citと比較して、Val-Alaは疎水性が低いため、PBDダイマーなどの疎水性ペイロードとの相性が優れていると考えられます。7つの臨床候補ADCでは、Val-AlaリンカーがPBDと結合しています。
一部の研究では、非内部取り込み型抗体におけるMMAEペイロードの結合について、Val-CitとVal-Alaジペプチドの構造を比較検討し、エンジニアードシステインに結合した場合、両者は類似の特性を示し、Val-LysおよびVal-Arg類似体よりも優れた性能を発揮することが確認されました。抗HER2 ADC(ヒト上皮成長因子受容体2、HER2)においてランダムシステイン結合の場合、Val-AlaリンカーはVal-Citリンカーに比べ高いDAR構造での凝集が少ないことが示されました。一方、両リンカーはバッファー安定性、カテプシンB放出効率、細胞活性、および組織病理学的特性において類似の性能を示します。
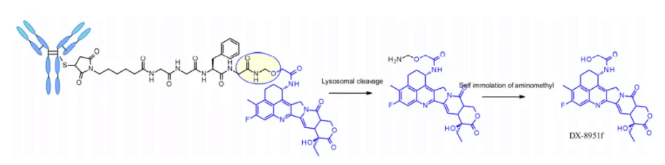
テトラペプチドのGly-Gly-Phe-Glyは、安定性と効果的な切断可能リンカーの全特性を示しており、承認ADC医薬品Enhertu®で採用されています。Enhertuの第一期は、血漿中で安定なADCでDARが7.7に達します。ライソソーム内でプロテアーゼ分解が起こり、dx-8951fが放出されます。これは、Exatecan由来の効果的なトポイソメラーゼI阻害剤です。リンカーに溶解性補助剤が含まれていないにもかかわらず、これほど高いDARに達するのは、従来「高DARの複合体は薬物動態特性が劣る」という広く認識された原則に反するため、非常に注目に値します。ここで使用される自己分解スペーサーは、Val-Citリンカーで使用されるPABCではなく、シンプルでコンパクトなヘミアミネーションです。
ホスファターゼおよびピロホスファターゼ
カテプシンと同様に、ピロホスファターゼおよびホスファターゼはライソソームに選択的に発現する加水分解酵素です。2016年、Merck社の研究者らは、自己分解スペーサーPABAとカテプシンB感受性のVal-Citリンカーを組み合わせ、グルココルチコイドを輸送するためのリンカーとして、ホスフェートおよびピロホスフェートを含むリンカーを設計しました。内部取り込み後、ペイロードはカテプシンB、自己分解スペーサー、ホスファターゼの順に放出されます(n = 1)。ピロホスフェート(n = 2)の場合は、さらにピロホスファターゼを必要とするステップが加わります。
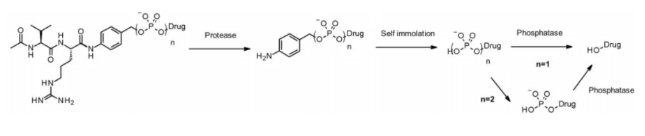
この親水性かつ恒久的に帯電した基は、溶解性の向上という利点を有し、疎水性のグルココルチコイド誘導体との生体結合だけでなく、ADCの精製も促進します。ADC中の残留リンカーは0.10%未満です。リン酸およびピロリン酸を含むADCはin vitroで活性を示します。
β-グルクロニダーゼ
β-グルクロニダーゼは、グルクロン酸残基のβ加水分解を触媒するグリコシダーゼであり、ライソソームおよび腫瘍間質で高発現しています。2006年、Seattle Geneticsの研究者らが画期的な成果を発表しました。抗CD70 ADCはグルクロニック酸を含むリンカーを用い、これが自己分解スペーサーに結合しています。このリンカーは、凝集が低く、血漿安定性が高く、in vivoで強い効果を示します5。
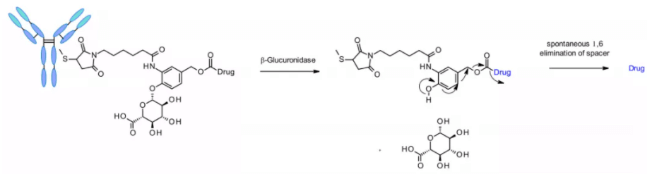
このリンカーは、カンプトテキン類似体、SN38、デュカマイシン、マトリンなど、アミン基を含む他のペイロードにも、追加のジメチルエチレンジアミン(DMED, DMED)自己分解スペーサーを介して適用されます。加水分解により、β-グルクロニック酸から自己分解スペーサーへ、さらにDMEDの自発的環化反応が起こり、1,3-ジメチルイミダゾリン-2-オンが形成され、最終的にヒドロキシル基を持つ薬剤が放出されます。リンカーの親水性のおかげで、カテプシン感受性リンカーと比較して、DAR=8のADC作製が容易となります。
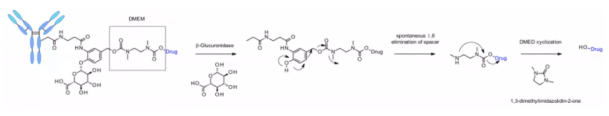
β-ガラクトシダーゼ
最近、β-ガラクトシダーゼを用いて、PEG10スペーサーを含むリンカーを切断する方法が開発されました。このスペーサーは、自己分解速度を向上させるためにニトロ基に置換されました。β-グルクロニダーゼリンカーと類似し、その解離機構は、β-ガラクトシダーゼ基の加水分解により化学前駆体に親水性を付与します。さらに、β-ガラクトシダーゼはライソソームにのみ存在するのに対し、β-グルクロニダーゼはライソソームおよび固形腫瘍の微小環境に発現しているという利点もあります。抗HER2 ADCにおいてMMAEの放出に関連する文脈で、β-ガラクトシダーゼリンカーを使用したADCは、in vitroおよびin vivoでt-DM1よりも効果的であることが示されています。
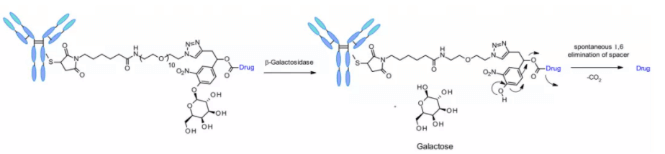
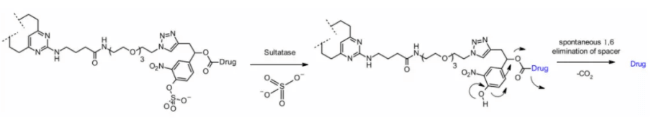
スルファターゼ
近年、いくつかのがん種で過剰発現し、選択性を示すスルファターゼによって切断されるリンカーも開発されています。抗HER2抗体にMMAEが荷重された製品で検討されており、古典的な切断可能リンカーであるVal-CitおよびVal-Alaと比較して、スルファターゼリンカーはHER2+細胞株において同等の効果を示しました。
Reference:
1. Su Z, Xiao D, Xie F, et al. Antibody-drug conjugates: Recent advances in linker chemistry [J]. Acta Pharmaceutica Sinica B, 2021.
2. Chen Y, Kim M T, Zheng L, et al. Structural Characterization of Cross-Linked Species in Trastuzumab Emtansine (Kadcyla) [J]. Bioconjugate Chemistry, 2016.
3. Seki H, Walsh S J, Bargh J D, et al. Rapid and robust cysteine bioconjugation with vinylheteroarenes. 2021.
4. Kostova V, Désos P, Starck JB, Kotschy A. The Chemistry Behind ADCs. Pharmaceuticals (Basel). 2021;14(5):442.
5. Kostova, V.; Désos, P.; Starck, J.-B.; Kotschy, A. The Chemistry Behind ADCs. Pharmaceuticals 2021, 14, 442.
6. Singh A P, Sharma S, Shah D K. Quantitative characterization of in vitro bystander effect of antibody-drug conjugates [J]. J Pharmacokinet Pharmacodyn, 2016, 43(6):567-582.
7. Aleksandr V. Yurkovetskiy; Natalya D. Bodyak; Mao Yin; A Novel Antibody–Drug Conjugate Platform Featuring High Drug Loading and a Controlled Bystander Effect







 抗体薬物複合体(ADC)のナレッジベースを見る:
抗体薬物複合体(ADC)のナレッジベースを見る: Facebook
Facebook LinkedIn
LinkedIn Twitter
Twitter
